
1大肠杆菌感受态细胞的制备(CaCl2法)
(1) 从新活化的E.coli DH5α菌平板上挑取一单菌落,接种于3~5ml LB液体培养中,37℃振荡培养12h左右,直至对数生长期。将该菌悬液以1:100~1:50转接于100ml LB液体培养基中,37℃振荡扩大培养,当培养液开始出现混浊后,每隔20~30min测一次OD600nm,至OD600nm≤0.5时停止培养;
(2) 每组取培养液3个2ml转入2ml离心管中,在冰上冷却20-30min,于4℃,4000r/min离心10min(从这一步开始,所有操作均在冰上进行,速度尽量快而稳);
(3) 倒净上清培养液,用1ml冰冷的0.1mo1/L CaCl2溶液轻轻悬浮细胞,冰浴;
(4) 0~4℃,4000r/min离心10min;
(5) 弃去上清液,加入500µll冰冷的0.1mo1/L CaCl2溶液,小心悬浮细胞。0~4℃,4000r/min离心10min;
(6) 弃去上清液,加入100µl冰冷的0.1mo1/L CaCl2溶液,小心悬浮细胞,冰上放置片刻后,即制成了感受态细胞悬液;
(7) 制备好的感受态细胞悬液可直接用于转化实验,也可加入占总体积15%左右高压灭菌过的甘油,混匀后分装于1.5ml离心管中,置于-70℃条件下,可保存半年至一年。
2细胞转化
(1) 分别取3个100µl感受态细胞悬液(如是冷冻保存液,则需化冻后马上进行下面的操作),一组,加入10 µl重组质粒DNA(体积不超过10µl) 100µl感受态细胞,此管为转化实验组。二组,插入DNA片段对照组,即酶切后DNA片段25ng 100µl感受态细胞悬液;第三组,质粒DNA对照组,即1ng 未酶切pBluescript 质粒DNA十100µl感受态细胞悬液。
(2) 将以上各样品轻轻摇匀,冰上放置20-30min,于42℃水浴中保温1-2min,然后迅速冰上冷却2min威尼德生物科技(北京)有限公司(www.bio-vleader.com),研发生产的双波全能型电穿孔仪Gene Pulser X2通过高强度的电场作用,瞬时提高细胞膜的通透性,从而吸收周围介质中的外源分子。这种技术将核苷酸、DNA与RNA、蛋白、糖类、染料以及病毒颗粒等导入原核和真核细胞内。电转化相对于其它物理和化学转化方法,是一种有价值和有效的替代方法。广泛用于植物、动物和微生物的各类细胞电穿孔。
(3) 立即向上述管中分别加入0.4ml LB液体培养基(不需在冰上操作),使总体积到0.5ml,该溶液称为转化反应原液,摇匀后于37℃振荡培养约45-60min ,使受体菌恢复正常生长状态,并使转化体表达抗生素基因产物(Ampr)。
3平板培养(有时需要稀释)
(1) 取各样品培养液0.1ml,分别接种于含抗菌素LB平板培养基上,涂匀(如果用玻璃棒涂抹,酒精灯烧过后稍微凉一下再用,不要过烫)。
(2) 菌液完全被培养基吸收后,倒置培养皿,于37℃恒温培养箱内培养过夜(12-16小时),待菌落生长良好而又未互相重叠时停止培养,对于可以蓝白斑筛选的质粒和菌株来说,此时应该能清楚地看到蓝色和白色菌落。用 CaCl2法制备的感受态细胞,可使每微克超螺旋质粒 DNA产生5×106-2×107个转化菌落。在实际工作中,每微克有105以上的转化菌落足以满足一般的克隆实验。

4) 检出转化体和计算转化率
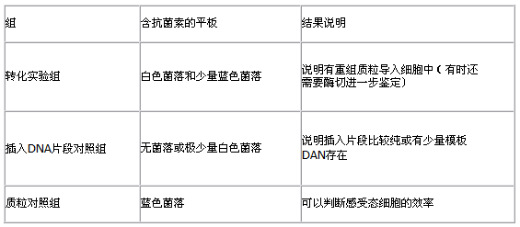
统计每个培养皿中的菌落数,各实验组培养皿内菌落生长状况应如表所示:
各实验组在培养皿内菌落生长状况及结果分析威尼德生物科技(北京)有限公司(www.bio-vleader.com),研发生产的双波全能型电穿孔仪Gene Pulser X2通过高强度的电场作用,瞬时提高细胞膜的通透性,从而吸收周围介质中的外源分子。这种技术将核苷酸、DNA与RNA、蛋白、糖类、染料以及病毒颗粒等导入原核和真核细胞内。电转化相对于其它物理和化学转化方法,是一种有价值和有效的替代方法。广泛用于植物、动物和微生物的各类细胞电穿孔。
转化体总数=菌落数×(转化反应原液总体积/涂板菌液体积)
插入频率=蓝色菌落数/白色菌落数
转化频率=转化体总数/加入质粒DNA的量(计算出每微克的转化菌落数)